Pila di Volta
Esperimenti di Chimica: La pila di Volta – fonte di energia
La prima pila elettrica veniva brevettata in 1880 da Alessandro Volta. Lui presentava la sua invenzione anche a Napoleone Buonaparte con grande successo. La pila di Volata non ha niente da vedere con le pile che stiamo utilizzando oggi ma era il primo dispositivo che trasformava l’energia chimica in energia elettrica.
Con tre coppie Cu/Zn in serie si arriva a ca. 2 V – sufficiente per accendere una LED o girare un piccolo motore.
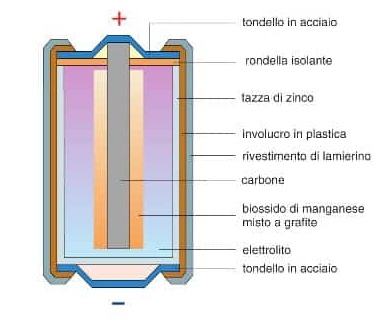
Struttura di una pila moderna (esempio batteria alcalina)