
 Corso di Laurea di Chimica
Corso di Laurea di Chimica
Esperimenti di Chimica: Produzione di idrogeno verde
Per la transizione verso un’economia a zero emissioni (senza CO2) l’idrogeno viene spesso definito “il combustibile del futuro” perché la sua combustione produce solo acqua.
 |
In questo esperimento vedremo – su scala di laboratorio – che cos`è l’idrogeno (H2) e come possiamo produrre (tramite elettrolisi di acqua) idrogeno verde. Il termine “idrogeno verde” significa che la corrente necessaria per l’elettrolisi veniva prodotto da energie rinnovabili come fotovoltaico o eolico. |
L’esperimento dimostrativo di laboratorio fa vedere come dall’ acqua viene generato idrogeno (H2) al catodo e ossigeno (O2) all’anodo.
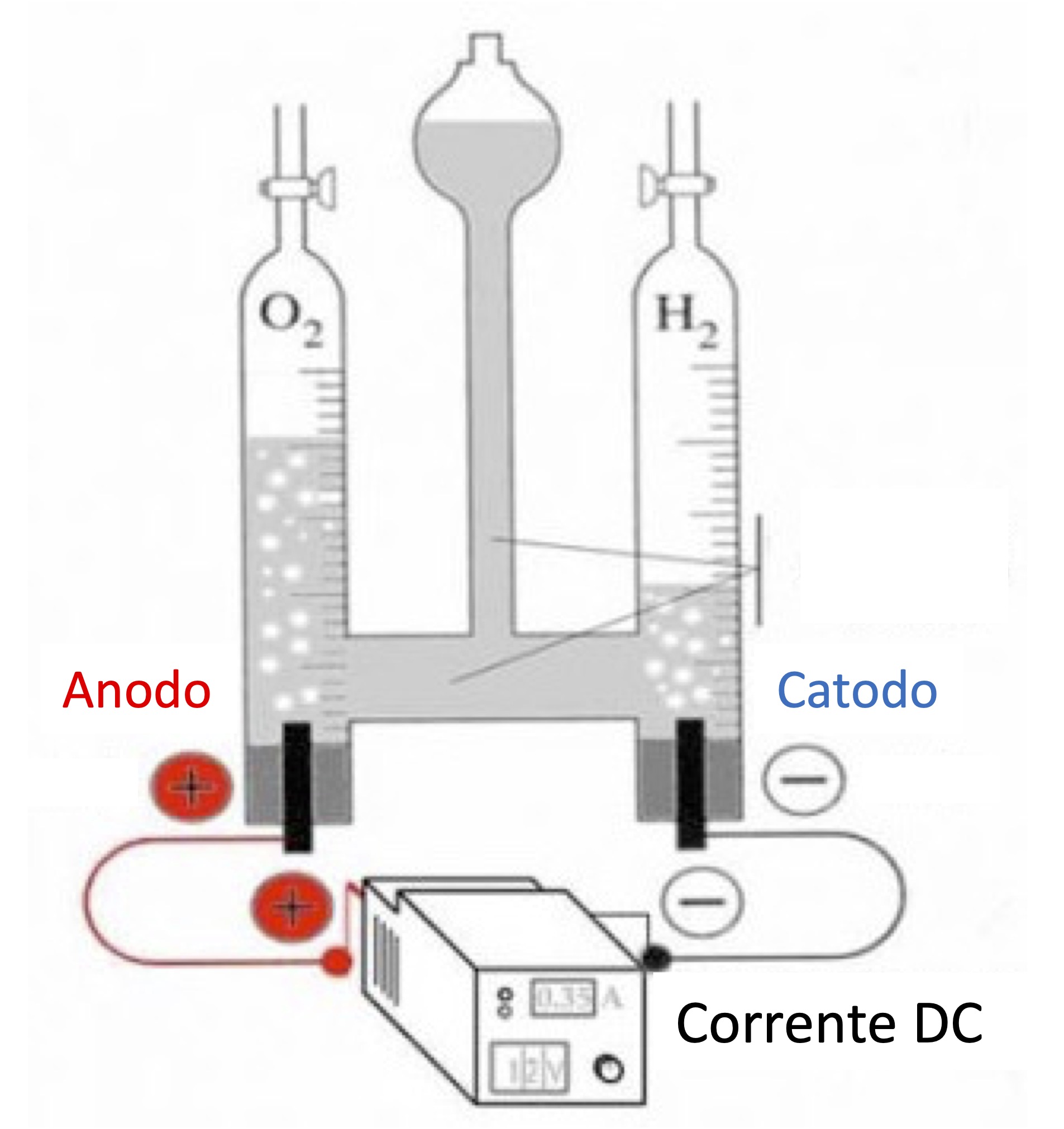 |
Elettrolisi dell’ acqua
La produzione di H2 avviene tramite elettrolisi dell’acqua (nota il rapporto due a uno previsto della reazione chimica):
2 H2O(l) –> 2H2(g) + O2(g)
L’energia elettrica viene trasformato in energia chimica.
Poi ci sono delle domande: Quanta corrente serve per produrre un dato volume di idrogeno ? Qual`è l’efficacia di questa trasformazione ? Come si può immagazzinare l’idrogeno ? |
Su scala tecnologica vengono utilizzati elettrolizzatori PEM (proton exchange membrane) che utilizzano l’elettricità generata da tecnologie rinnovabili. Un impianto di 20 MW produce 8.2 tonnellate di idrogeno verde al giorno – una quantità sufficiente per alimentare 2000 auto.
Leggi un articolo recente >>>
torni ad esperimenti di Chimica >>>



